Morfogénesis de materiales nanocristalinos autoensamblados de carbonato de bario y sílice
publicado en Science 16 de Enero de 2009
Juan Manuel García-Ruiz1, Emilio Melero-García1, Stephen T. Hyde2
1Laboratorio de Estudios Cristalográficos, IACT (CSIC-UGR), Avda. del Conocimiento s/n, P.T. Ciencias de la Salud, 18100 Armilla, Spain.
2Departamento de Matemática Aplicada, Escuela de Investigación en Ciencias Físicas, Universidad Nacional de Camberra, Canberra, ACT 0200, Australia.
Resumen
La precipitación de carbonatos de bario o estroncio en entornos alcalinos ricos en sílice da lugar a unos agregados cristalinos que han sido bautizados con el nombre de biomorfos de sílice/carbonato, debido a su parecido con la morfología de organismos primitivos. Estos agregados son materiales autoensamblados totalmente inorgánicos formados por una fase amorfa de sílice íntimamente entrelazada con una fase de carbonato nanocristalino. En este trabajo proponemos un mecanismo que explica todas las morfologías que han sido descritas para los biomorfos. La coprecipitación químicamente acoplada del carbonato y la sílice produce una fibrilación del frente de crecimiento que resulta en unas estructuras laminares, las cuales sufren un rizado de sus bordes de crecimiento. Los rizos se propagan a lo largo del borde de las laminas como olas de surf. Aquí demostramos que todas las morfologías observadas con curvatura gausiana suavemente variable, positiva o negativa, pueden explicarse a través del crecimiento combinado de rizos que se propagan en sentidos contrarios sobre el mismo borde y de la lámina sobre la que se propagan.
La morfología teórica de cristales clásicos está bien acomodada en el seno de la teoría convencional de crecimiento cristalino. Esta teoría explica el desarrollo de las diferentes caras de un cristal como un efecto de las diferencias relativas de las energías cristalográficas superficiales a nivel atómico, mientras la simetría globa queda fijada por el empaquetado a escala atómica. Las relaciones entre las formas fuera de equilibrio de los cristales y sus condiciones físico-quimicas de crecimiento forman parte también de la visión general de la teoría (1). Sin embargo, y a pesar de las numerosas observaciones a lo largo de los años (2) de que la vida es capaz de crear formas precisas, suaves y diferenciables, compuestas de materiales minerales policristalinos (conchas, dientes, huesos), los mecanismos que dan lugar a la formación de estas fascinantes arquitecturas son todavía muy poco conocidos. La síntesis en laboratorio de estructuras realmente auto-ensambladas que imiten la capacidad que tiene la vida para crear morfologías sinuosas no cristalográficas, usando para ello materiales cristalinos, constituye todavía todo un desafío. Entre los pocos ejemplos conocidos de materiales nanocristalinos auto-organizados obtenidos sintéticamente, en los que se ha observado que muestran una riqueza de morfologías comparable a la de biominerales, se encuentran los biomorfos de sílice/carbonato (3-5). Estos biomorfos, al igual que los biominerales, exhiben un ordenamiento atómico a escala nanométrica pero, sin embargo, adolecen de una falta transnacional a largas distancias. Como consecuencia, no se expresan caras ni bordes característicos sino que se encuentran limitados por superficies suavemente curvadas. Así, los biomorfos, cuyo mecanismo de formación ha venido siendo un misterio (5-7), muestran un zoo de morfologías curvilíneas que a menudo resultan indistinguibles de aquellas encontradas en biomateriales formados in vivo.
Los biomorfos de sílice/carbonato de bario se pueden obtener de forma rutinaria mezclando una solución de cloruro de Bario con soluciones y geles de sílice, a un pH entre 8.5 y 11, y a presiones y temperaturas ambientales (8). En condiciones alcalinas iones carbonato formados por la disolución de CO2 atmosférico reaccionan con iones Ba2+ para precipitar cristales de carbonato de bario (witerita) que tienen forma de crystales prismáticos pseudos-hexagonales acabados en los extremos por caras bipiramidales (9). Se ha demostrado (3-7,10,11), sin embargo, que cuando el carbonato de bario cristaliza a partir de soluciones ricas en sílice, o a partir de geles de sílice, forma agregados policristalinos que muestran una variedad de morfologías, a escalas de µm y de mm, delimitadas por superficies “diferenciables” de curvatura Gaussiana bien definida y suavemente variable. Asimismo se ha establecido que su estructura submicrométrica se compone de cristales nanométricos de witerita en forma de barras, que se presentan con una elevada ordenación orientacional pero evidenciando una falta de orden traslacional. Los nanocristales de carbonato aparecen recubiertos por sílice amorfo (SiO2), que a la vez actúa cementando la estructura, formándose así un material compuesto como se ha demostrado por la capacidad de disolver selectivamente la fase cristalina o amorfa, usando soluciones diluidas de HCl o NaOH respectivamente (12).
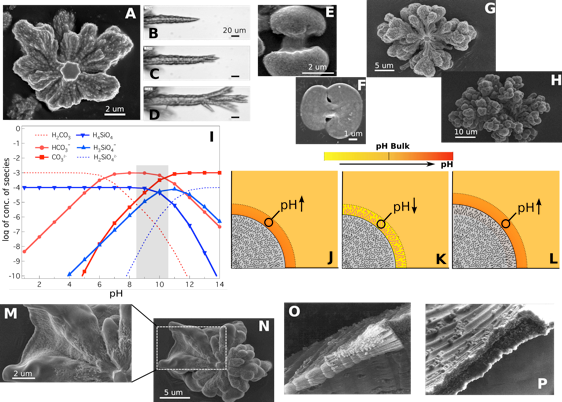
Figura 1: La rotura de la simetría cristalográfica y el acoplamiento químico. (A a H) ilustran la transición desde un único núcleo cristalino pseudo-hexagonal mostrado en (A) hacia estructuras de hatillo de trigo [(E) y (F)] y globulares [(G) y (H)], a través de la ramificación de la punta pinacoidal o bipiramidal del núcleo cristalino [(B a D)]. Los paneles [(B a D)] son fotogramas de un vídeo (ver Película S4). El dibujo (I) muestra la concentración de las especies química en función del pH, (29) y la region de pH (en gris) en la que se forman estas estructuras. Los paneles (J a L) muestran de forma esquemática el crecimiento de un frente fibrilado debido a las oscilaciones en el pH local forzadas por la precipitación acoplada de la sílice y el carbonato. Los cuatro últimos paneles muestran el comienzo de la formación (M y N) y algunos detalles de las estructuras laminares (O y P).
Hemos empleado video-microscopía de intervalo temporal y microscopía de electrones para seguir el nacimiento, el desarrollo del crecimiento y las morfologías y texturas finales de los biomorfos de witerita (8). Nuestras observaciones han establecido que el núcleo inicial de todas las morfologías es un cristal prismático maclado pseudo-hexagonal de witerita, que crece preferentemente a lo lago de su eje c (Fig. 1A). Las morfologías descritas parecen surgir de la sucesiva rotura de la simetría cristalográfica de este núcleo cristalino de carbonato que ocurre a lo largo de dos rutas diferentes, pero consecutivas. La primera de estar rutas lleva la simetría cristalográfica hacia una simetría de dilatación, mientras que la segunda continua hacia una simetría rotacional. La ruta de dilatación acaba dando lugar a morfologías fractales semejantes a coliflores, mientras que la ruta rotacional da lugar a microestructuras tridimensionales (3D) que exhiben una enorme variedad de superficies curvadas de curvatura Gaussiana uniformemente variable.
La simetría cristalográfica se rompe inicialmente hacia la simetría de dilatación a través de una ramificación de la base pinacoidal {001} o de las caras bipiramidales pseudohexagonales del núcleo cristalino en crecimiento. Gracias al trabajo pionero de Keith y Paden (13) la ramificación cristalina en ángulos no cristalográficos puede explicarse por la acumulación en el frente de crecimiento de impurezas poliméricas no absorbibles, las cuales son expulsadas y empujadas hacia fuera del cristal en crecimiento y originan la formación de islas bidimensionales que están ligeramente desorientadas con respecto a la red cristalina original (13-15). Estas islas siguen creciendo creando un saliente inclinado que forma un ángulo no cristalográfico con la semilla inicial (Fig. 1, B a D). En condiciones alcalinas, y como resultado del acoplamiento químico del carbonato y la sílice, el proceso de precipitación de carbonato cristalino induce a la formación de impurezas poliméricas en el frente de crecimiento, lo que a su vez induce a la precipitación de más carbonato.
Este proceso químico retroalimentado ocurre de la siguiente manera: durante la cristalización del carbonato de bario hay una eliminación continua de grupos carbonato lo que reduce el pH del entorno local que rodea los cristales en crecimiento según las reacciones:
Ba2+ + CO32- BaCO3
HCO3- + H2O H3O+ + CO32-
Por otro lado, la precipitación de sílice se produce exclusivamente a través de la condensación de moléculas de ácido silícico Si(OH)4 (16). A pH alcalinos el ácido silícico se deprotona según:
Si(OH)4 SiO(OH)3- + H3O+ a pH = 9
SiO(OH)3- SiO2(OH)22- + H3O+ a pH = 10.7
Por lo tanto, la disminución del pH causado por la precipitación de carbonato eleva la supersaturación local del ácido silícico en la vecindad de los cristales de carbonato en crecimiento, provocando así la adsorción y precipitación de sílice en sus caras cargadas positivamente (17), emponzoñando el crecimiento cristalino, y dando lugar a la ramificación de los cristales. Éste acoplamiento químico asegura una ramificación continuada en ángulos no cristalográficos, dando lugar a la formación de estructuras en forma de hatillo de trigo y, tras un crecimiento continuado, a estructuras que llenan el espacio de forma semejante a las coliflores (Fig. 1E-H) (18,19).
A los valores elevados de pH típicos de las condiciones de crecimiento de biomorfos la solubilidad de la sílice es más sensible a cambios en el valor de pH (Fig. 1I). Por lo tanto, la cantidad de sílice que recubre los nanocristales es lo suficientemente grande como para provocar el cese del crecimiento cristalino. A su vez, la precipitación de sílice amorfo eleva el pH local a través de la conversión de los grupos acídicos –OH en enlaces siloxano. Ésta elevación del pH promueve la formación adicional de iones carbonato, lo que eleva la supersaturación del carbonato de bario y de ésta manera lleva a una nueva nucleación de carbonato en forma de nucleación tridimensional (Fig. 1, J a L). Éste proceso provoca la fragmentación de los frentes de crecimiento monocristalinos en un frente policristalino de nanocristales coorientados con el monocristal. A ésta transformación la denominamos fibrilación. A pesar de que el mecanismo de fibrilación sea consecuencia de un comportamiento oscilatorio del pH en el frente de crecimiento, esto no origina necesariamente una dinámica oscilatoria del frente de crecimiento.
La subsiguiente precipitación de sílice evita que estos núcleos puedan crecer más allá de unas pocas decenas o cientos de nanómetros antes de que queden casi completamente cubiertos con sílice, y por lo tanto tengan una carga superficial neta negativa a pH alcalinos. La repulsión mutua entre estás partículas de witerita-sílice se ve apantallada por los cationes (Na+ y el exceso de Ba2+) en solución. Como consecuencia, los nanocristales de witerita-sílice sufren sólo unas fuerzas de interacción débiles, que sin embargo deben ser netamente atractivas para explicar la casi coorientación de las partículas a lo largo de su eje mayor. Ésta coorientación puede ser estabilizada ademá por la condensación de grupos silanol y la subsiguiente formación de enlaces siloxano entre partículas vecinas (16). Sin embargo, la ausencia de un orden traslacional estricto es también indicativo de la debilidad de la interacción entre partículas.
En un determinado momento, a través de la fibrilación, tiene lugar una transición desde cristales continuamente ramificados hacia unos agregados nanocristalinos con forma laminar y simetría radial macroscópica (Fig. 1, M a P). Las voluptuosas morfologías finales características de los biomorfos crecen pues en ausencia de restricciones cristalográficas según el siguiente mecanismo. El frente de crecimiento de la lámina avanza linealmente con el tiempo, y dado que la tasa de crecimiento radial es independiente del ángulo acimutal φ, la lámina genera al principio un disco circular con un borde de crecimiento en forma de arco. La vídeomicroscopía de intervalo temporal revela la formación ocasional de un pequeño reborde rizado en puntos discretos del borde de crecimiento. Este rizado causa que en ese punto: a) cese el crecimiento a lo largo de la dirección radial, y b) se formen dos frentes de crecimiento nuevos, situados a la derecha e izquierda del rizo (Película S1). Estos frentes de crecimiento propagan el rizo a lo largo del perímetro de la lámina, de forma muy parecida a como una ola de surf se mueve formando en el camino un borde en forma de túbulo (Fig. 2A). Según avanza este rizo a lo largo del borde de la lámina cicular va deteniendo la propagación de la estructura en la dirección radial: el frente del rizo se propaga a una velocidad constante y tangente al perímetro circular, mientras que la velocidad radial del perímetro ahora rizado pasa a ser cero. Como resultado, el punto en el cual la lámina plana comienza a rizarse sigue una trayectoria que es la resultante de dos frentes de crecimiento ortogonales: la velocidad de crecimiento radial Vρ de la lámina y la velocidad de propagación acimutal Vϕ del rizo, tal y como se muestra en la Figura 2B. Cuando dos frentes de rizo se aproximan el uno al otro a lo largo del borde y desde direcciones opuestas (sin que importe si provienen del mismo o de diferentes puntos de rizado) describen la característica forma cardiode o de hoja como consecuencia de la continua reorientación del borde de crecimiento inducida por la suma de los ángulos ’ ’’ ’’’, siendo ésta la explicación del origen de dicha morfología (Fig. 2, B a F).
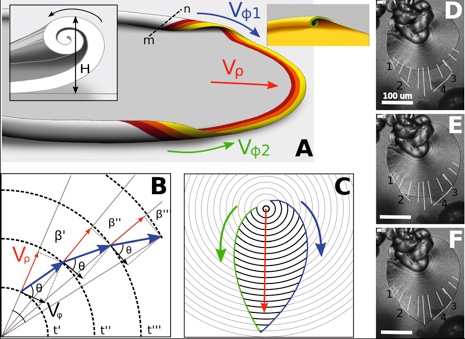
Figura 2: La morfogénesis de la forma de hoja y los parámetros del rizo descritos en el texto. El panel (A) muestra un visión de artista de dos rizos que se propagan en oposición a lo largo del borde the una lámina en crecimiento. El panel insertado muestra una sección del rizo (a través de la línea punteada m-n) en el que se muestra el parámetro H descrito en el texto. Los colores señalan la historia temporal del crecimiento del agregado, siendo el amarillo el que denota el frente de crecimiento presente. Los paneles (B y C) muestran un esquema del origen de la morfología hojiforme como un resultado de la propagacion de frentes rizados a lo largo del borde. La forma final viene determinada por la razón entre las velocidades Vϕ1, Vϕ2 de cada rizo y Vρ, lo que fija el ángulo θ, y el punto concreto en espacio y en tiempo en el que se surgen los rizos. Esto se ilustra en los fotogramas (D y F) de la Película S7, en donde las medidas de las velocidades dieron como valores Vρ= 0.91(3) μm/min a lo largo de las líneas radiales blancas y Vφ2 = 2.0(3) μm/min (líneas marcadas como 1-2) y Vφ1 = 2.8(3) μm/min (líneas marcadas como 3-4).
Éste sencillo rizo pone en movimiento un mecanismo morfogenético que explica toda la variedad de morfologías tridimensionales encontradas en los biomorfos de sílice. The parameters involved in the morphogenesis are the following (Fig. 2A): a) La direccionalidad relativa del rizo, sea a derechas (D) o a izquierdas (L); b) Los valores relativos de las velocidades acimutales Vφ de los bordes rizados que se aproximan, así como sus valores en relación a la velocidad radial, Vρ, de la hoja no rizada. c) La altura relativa H de los rizos que se aproximan. Las siguientes formas características de los biomorfos emergen como casos específicos de este mecanismo:
1.Morfogénesis de morfologías hojiformes (L1D2 or D1L2 ; H1 = H2 ; Vφ1 Vφ2 Vρ ) : Para formar una hoja los frentes the rizado que se aproximan deben tener diferente sentido de rizo y su altura debe ser del mismo valor. Así, cuando los dos rizos se encuentran sus frentes de crecimiento se sellan en una única cúspide. El contorno general de la forma de hoja y la existencia de una simetría bilateral (un plano de simetría a través de la cúspide) va a depender de las velocidades relativas de crecimiento en la dirección acimutal (Fig. 2).
2.Morfogénesis de helicoides de anchura constante (L1L2 or D1D2 ; H1 = H2 ; Vφ1 ≈ Vφ2 ≈ Vρ ): Los dos rizos que se aproximan tienen el mismo sentido y alturas similares. Además, la velocidad de crecimiento acimutal de ambos bordes es similar, y similar a la tasa de crecimiento radial de la hoja sin rizar. De esta manera se forma una helicoide perfecta que avanza linealmente con el tiempo. (Fig. 3).
3.Morfogénesis de helicoides de anchura decreciente (L1L2 or D1D2 ; H1 ≈ H2 ; Vφ1 ≈ Vφ2 > Vρ): Los dos rizos que se aproximan tienen el mismo sentido y alturas similares, pero la velocidad acimutal de los bordes es mayor que la tasa de crecimiento de la hoja sin rizar. La helicoide resultante muestra un paso constante pero tiene un diámetro que decrece de forma lineal. Si Vφ1 y Vφ2, son diferentes pero mayores que Vρ, el diámetro de la helicoide decrece de forma asimétrica (Película S2).
4.Morfogénesis de la trenza (L1L2 or D1D2 ; H1≈ H2 ; Vφ1 ≈ Vφ2 > Vρ): Las velocidades de crecimiento acimutales de los bordes opuestos son mucho mayores que la velocidad de la lamina sin rizar. Por lo tanto la lámina sin rizar es adelantada por una trenza, que se forma porque los dos rizos de igual sentido se enrollan el uno sobre el otro (Fig. 3D).
5.Morfogénesis de estructuras con forma de gusano (L1L2 or D1D2 or L1D2 ; H1 >> H2 ; Vφ1 ; Vφ2 ; Vρ): Si la altura y la tasa de crecimiento acimutal de uno de los rizos es mucho mayor que la del otro, entonces– y sin que importe el sentido de los bordes– al interaccionar el mayor acaba enrollándose sobre sí mismo. Este enrollamiento puede propagarse hacia delante o hacia atrás, provocando la morfología de gusano observada en los biomorfos de sílice (Películas S3-S5).
Merece la pena observar que todas las formas retorcidas se forman cuando los dos rizos poseen el mismo sentido de giro. Dado que cualquiera de los enantiomorfos tiene la misma probabilidad de formarse que el otro, no puede esperarse la existencia de un sesgo quiral, y como consecuencia los biomorfos de sílice son racémicos por naturaleza.
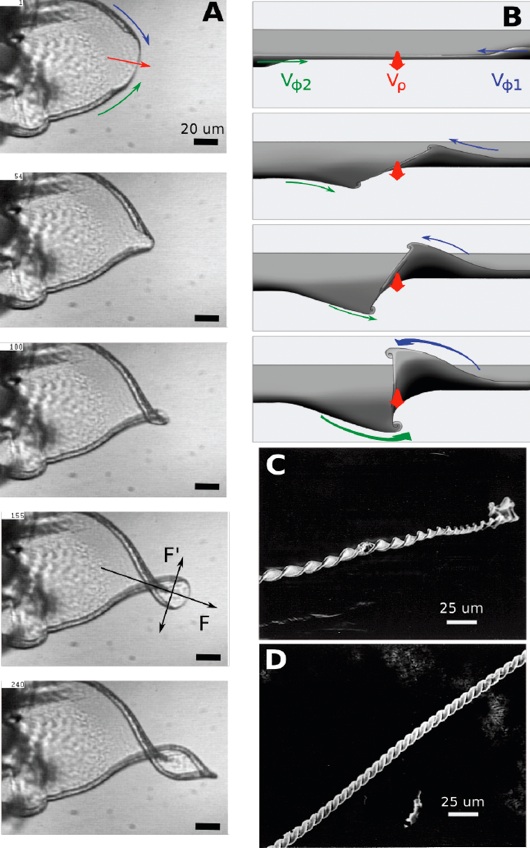
Figura 3: Formación de las helicoides. Cuando dos rizos propagándose en direcciones opuestas y con el mismo sentido de rizo se aproximan el uno al otro, la parte plana de la lámina sigue creciendo hacia fuera con velocidad Vρ. Según los rizos se aproximan, la lámina se curva en el mismo sentido de giro de los rizos. En el panel (A) se muestra una serie de fotogramas de la S8 en donde se observa la formación de una helicoide. El panel (B) es una ilustración con perspectiva frontal de dos rizos de igual sentido retorciéndose para formar una hélice. Distintos tipos de morfologías helicoidales pueden producirse dependiendo de los valores relativos de las tasas de crecimiento. Para velocidades acimutales iguales o casi iguales de ambos frentes rizados, y comparables con la tasa de crecimiento radial Vρ, la lámina y los dos bordes rizados se encierran en un modo acoplado de crecimiento en el que los rizos se propagan a lo largo de los bordes de la lámina central, obligando a ésta a un torcimiento continuo en el sentido de los rizos y a lo largo de la dirección F indicada en (A). Dado que el crecimiento de la lámina central en la dirección F’ perpendicular a F está inhibida por la propagación de los rizos por el borde, una helicoide de anchura prácticamente constante surge desde el lugar de la lámina en donde se encuentran los rizos. Los paneles (C y D) muestran vistas de microscopía electrónica de barrido de una helicoide de anchura constante y de una trenza, respectivamente.
El mecanismo de crecimiento propuesto explica un número de propiedades de simetría de los biomorfos que han constituido un misterio durante muchos años. La forma de hoja, tan característica de los biomorfos de sílice, es el resultado inevitable de la interacción mutua de dos rizos que se propagan en direcciones opuestas. Aún más, las formas “regulares”, con distribuciones uniformes de curvaturas sobre su superficie (como por ejemplo esferas retorcidas, o superficies retorcidas en general), son menos comunes que las formas más irregulares, dado que la regularidad geométrica en este sentido requiere razones fijas de las velocidades de crecimiento a lo largo de períodos extensos de tiempo. Éste mecanismo también explica la ausencia de quiralidad en los biomorfos de sílice dado que el sentido de las estructuras helicoidales depende en el signo relativo del sentido de los rizos, que es arbitrario. Por último, éste mecanismo explica el fracaso en los intentos de inducir quiralidad en los biomorfos de sílice mediante moléculas quirales: el origen del rizo ocurre a una escala de longitud mucho mayor y está por lo tanto desacoplada de la química molecular.
La combinación del rizo y del comportamiento de crecimiento radial descrito en este trabajo producen la variedad de formas curvilíneas observadas en biomorfos, sin la presencia de agentes biomoleculares, como las proteínas, que dirijan el crecimiento a través de adsorbción superficial. Se deduce, pues, que formas curvas complejas no son exclusivas de la biología. El mecanismo morfogenético descrito puede contribuir a la morfogénesis de otros precipitados exóticos inorgánicos (25-28). Por último, evidencias de nanobacterias (24), restos primitivos de vida terrestre (3,20) y marciana (21-23) no pueden estar basadas solamente en la morfología.
Referencias
1. I. Sunagawa, Crystals: Growth, Morphology and Perfection (Cambridge University Press, 2005), pp 295.
2. D. W. Thompson, On Growth and Form (Cambridge University Press, 1942), pp 345.
3. J. M. García-Ruiz, et al., Science 302, 1194-1197 (2003).
4. J. M. García-Ruiz, Geology 26, 843-846 (1998).
5. S. T. Hyde, A. M. Carnerup, A. Larsson, A.G. Christy, J. M. García-Ruiz, Phys. A 339, 24-33 (2004).
6. T. Terada, S. Yamabi, H. Imai, J. Crys. Growth 253, 435-444 (2003).
7. J. M. García-Ruiz, J. Crystal Growth 73, 251-262 (1985).
8.“Materials and Methods are available as supporting material on Science Online”
9. F. Lippmann, Sedimentary Carbonate Minerals, (Springer, Berlin, 1973).
10. E. Bittarello, D. Aquilano, Eur. J. Mineral 19, 345-351 (2007).
11. A. E. Voinescu, et al., J. Crystal Growth 306, 152–158 (2007).
12. J. M. Garcia-Ruiz, J. L. Amorós, J. Crystal Growth 55, 379-383 (1981).
13. H.D. Keith, F. J. Padden, J Appl Phys. 34, 2409-2421 (1963).
14. N. Goldenfeld, J. Crystal Growth 84, 601-608 (1987).
15. P. Philips, In Handbook of Crystal Growth. (Vol. 2, Chapter 18, Elsevier: Amsterdam 1993), pp. 1169-1216.
16. R. K. Iler, The Chemistry of Silica (Wiley, New York, 1979).
17. C-C. Li, J-H. Jean, J. Am. Ceram. Soc. 85, 2977–2983 (2002).
18. D. P. Grigoriev, Ontogeny of Minerals (Israel Program for Scientific Translation, Jerusalem, Israel, 1965) pp. 250.
19. M. N. Maleev, Tschermaks Mineralogische und Petrographische Mitteilungen 18, 1–16 (1972).
20. J. M. García-Ruiz, A. Carnerup, A.G. Christy, N. J. Welham, S. T. Hyde, Astrobiology 2, 353-369 (2002).
21. F. Poulet, et al., Nature 438, 623–627 (2005).
22. J. F. Mustard, et al., Nature 454, 305-309 (2008).
23. F. Westall, Space Sci. Rev. 135, 95–114 (2008).
24. J. Martel, D. J. Young, PNAS 105, 5549–5554 (2008).
25. H. Cölfen, Current Opinion in Colloid and Interface Science 8, 23–31 (2003).
26. H. Cölfen, M. Antonietti, Angew. Chem.–Int. Edit. 44, 5576–5591 (2005).
27. L. B. Gower, D. J. Odom, J. Crystal Growth 210, 719-734 (2000).
28. S. Mann, G.A. Ozin, Nature 382, 313-318 (1996).
29. C. B. Andersen, J. Geoscience Education 50, 389-403 (2002).
30. Estamos agradecidos a Nicholas J. Welham (Australian National University, ahora en University of Ballarat) por varias de las grabaciones de videomicroscopía. Este trabajo ha sido apoyado económicamente por el Ministerio Español de Educación y Ciencia (MEC) (PNE Project ESP2005-23831-E) y es parte del proyecto Consolider-Ingenio 2010 “Factoría Española de Cristalización”. E. Melero-García agradece el apoyo económico del programa Juan de la Cierva (MEC). S.T. Hyde agradece al Australian Research Council por una Federation Fellowship.
